◇「条件・期限付き承認を受けた再生医療等製品の“新たな算定ルール” 筋ジストロフィー向けエレビジス点滴静注が新ルールの初適用例」から読みとれるも
・「承認後の評価が合理的・実施可能」が前提
・iPS細胞製品など加速度的に増加する再生医療等製品
・既存医薬品とは根本的に異なる構造を持つ再生医療等製品
■中医協、条件期限付き再生医療等製品の対応で新算定ルール
中医協は2026年1月14日の総会で、条件・期限付き承認を受けた再生医療等製品への対応(新たな算定ルール)について、診療・支払各側が了承、新たな価格算定方法が即日で適用された。対応案では、「薬事承認に際して条件及び期限付き承認後における計画が有効性及び安全性の評価が合理的かつ実施可能」を前提とすることを明記。原価計算方式により算定される場合に用いる営業利益率の係数は、「平均的な営業利益率に0.5を乗じた値を用いることや、有用性系加算については薬価・材料価格算定時には該当性を判断しないこと」を明確化した。
“新たな算定ルール”の主なポイントは、①原価計算方式の場合、 営業利益率の係数は平均的な営業利益率に0.5を乗じた値。②有用性系加算(画期性加算、有用性加算及び改良加算)は付与なし。③市場生加算等は付与の可能性あり。④外国平均価格調整は適用の可能性あり。⑤市場拡大再算定は適用の可能性あり。⑥費用対効果評価は適用なし。⑦新薬創出・適応外薬解消等促進加算(革新的新薬薬価維持制度)は適用の可能性あり-となっている。原価計算方式の係数見直し、有用性系加算の適用、費用対効果評価の適用については、本承認時に再度議論されることになる。
薬価・材料価格収載後の対応としては、市場拡大再算定の適用は「通常の承認を受けた再生医療等製品と同様に取り扱う」とした。改めて通常の承認を受けた際には、「原価計算方式により算定された場合の営業利益率の係数、補正加算の適用又は控除について、薬価算定組織又は保険医療材料等専門組織において検討した上で、中医協総会の了承を経る」こととする。補正加算率の計算に当たっては、「新規収載品目に対する補正加算率の算式と同様とする」とした。
同日の中医協総会で薬価収載に向けた議論を進めることが了承された、デュシェンヌ型筋ジストロフィー(DMD)を適応症とする再生医療等製品「エレビジス点滴静注」を第1号として、新たなルールを適用する。
■加速度的に増加する再生医療等製品は2025年12月時点で21品目
細胞医療や遺伝子治療など再生医療等製品の特長と患者に提供しうる価値として、従来の治療法では難しかった疾患の治癒や生活の質の向上に貢献。臨床試験の実施及び臨床実装から数年が経過し、少ない投与で持続的な効果が確認されている。
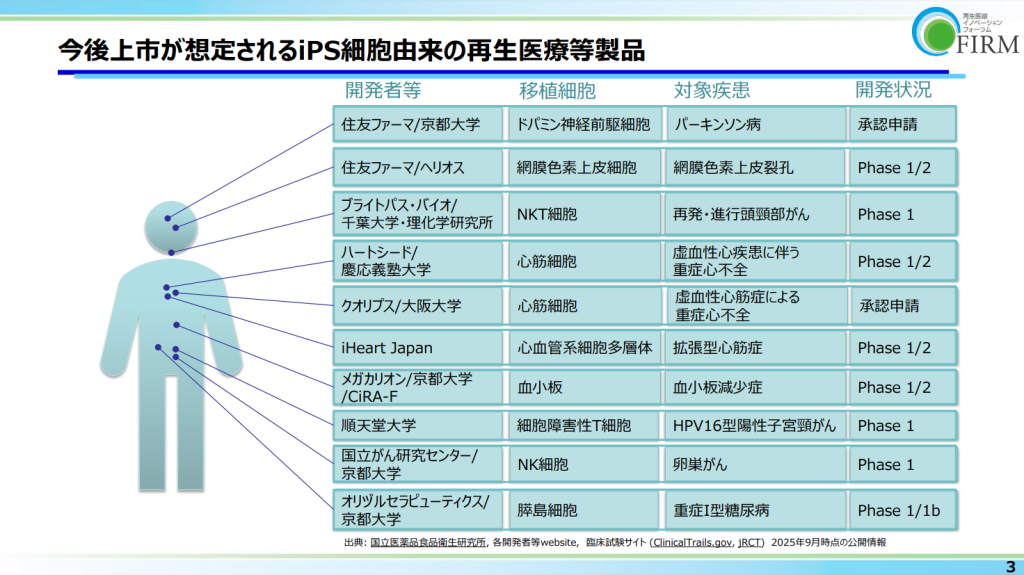
国内で承認された再生医療等製品は2025年12月時点で21品目、近年はその品目数は加速度的に増加、今後、iPS細胞製品等、新たな再生医療等製品の承認が想定される。(図7 今後上市が想定されるiPS細胞由来の再生医療等製品)
一方、2024年に条件・期限付き承認品 4品目中2品目(ハートシート、コラテジェン)が本承認に至らず保険削除され、「条件付き承認 → 保険適用 → 本承認に至らず消える」というリスクが顕在化。条件・期限付き承認制度の運用改善が求められていた。(図8日本における再生医療等製品の承認は加速度的に増加)
再生医療等製品は、①研究開発から医療機関における投与まで、既存医薬品とは異なる知財、人材、コスト、原材料や専用設備が必要となる。②患者ごとに個別化された製品もあり、需要が増加しても、1製造にあたる費用の削減は困難となる。③希少疾患のため対象となる患者は少なく、多額な投資に対して収益の確保が困難である-など、既存医薬品とは根本的に異なる構造を持つ。このため、薬価制度の前提である「大量生産によるコスト逓減」「製造販売業者中心の原価評価」「長期的な治療効果の確実性」といった枠組みが適合しにくい。承認品目が加速度的に増える中で、成果連動型支払い、医療機関負担の評価、HTA(医療技術評価)の拡張など、制度側のアップデートが不可避となっている。
ヒト骨格筋由来細胞シートである「ハートシート」がお目見えした時、凄い技術だと感銘を受けた。過去に澤芳樹先生のお話を直接うかがう機会も何度かあったし、昨年大好評の中閉幕を迎えた「大阪・関西万博2025」でも目玉技術として、万博が始まる前からも話題の技術であったと記憶している。「医の知」(いのち)というテーマや発送も、万博に向けたキャッチコピーもさることながら、この技術が背景にあるからではないかとすら思えるほどだった。
テルモ社のハートシート(商品名)は2015年に国内第1号の再生医療等製品として条件及び期限付き承認を受け販売されたが、本文中にもあるとおり、2024年の本承認申請に対する審査の結果、有効性が示されなかったとして「不承認」と結論付けられ、2024年7月をもって承認が失効し、販売が終了している。このハートシートは、本人の足の筋肉を採取・培養してシート状にしたものだった。「自分の」ではあるが「足の筋肉」を基にしたシートを心臓に貼付して、心臓の動きを、いわばサポートするような効果(いずれ筋肉等に置き換わる?)が期待されていたが残念な結果であった。
紛らわしいようだが、【図‐7】今後上市が想定されるiPS細胞由来の再生医療等製品に出ているのは、商品名でなく「ハートシード」社、慶応義塾大学発のベンチャー企業の社名である。ハートシード社が開発した技術は、他人のiPS細胞から作製した高純度の「心筋球」を心臓に注入する治療法で、心筋そのものを再生させることを目指しているという。
だから、澤先生の研究は決して終わったのではなく、ハートシートの研究も糧に、今でも進化を続けているのだ。「医の知」は今も進化を続けている(【図‐7】再掲)。
今回は、前出の「ハートシート」のような条件・期限付き承認を受けた再生医療等製品の“新たな算定ルール”がテーマである。
まずはこんなコメントから。
〇厚生労働副大臣:日本の再生医療は経済的に“稼げる”、世界をリードする大きなフィールド
2025年8月東京都内で開催した政策フォーラムで、仁木博文厚生労働副大臣(当時)は、「日本の再生医療はこれからだが、経済的に“稼げる”、世界をリードする大きなフィールドだ」と期待感を込めた。その上で、メリハリをつけたヒト・カネの投資が求められると強調。規模の経済性が働かないCAR-T細胞療法は特異的な治療法だと述べながら、「従来の薬価制度でカバーしきれない面が多々ある」と指摘し、患者のQOLを含めた費用対効果の検討など、再生医療等製品ならではの価格算定のあり方に踏み込む必要性を強調した。
「CAR-T細胞療法」については、W・M・N 2019年6月号でとり上げたので、ご参照されたい。同療法に使用する点滴静注「キムリア」の薬価が一患者当たり33,493,407円と過去最高額だった、というテーマだった。
「3千万」という最高額ではあるが、確かにこの治療法は誰にでも適応するわけでなく、拡がりという点において「規模の経済性が働かない」と当時の副大臣が仰ったのは、そういう背景があったからだろう。
次はこんなコメントを。
〇厚生労働大臣:再生医療等製品を含む新規治療の評価に取り組む
上野賢一郎厚生労働大臣は昨年10月30日の大臣就任記者会見で、革新的医薬品へのアクセス確保について「創薬力の強化と医薬品の安定供給を図りつつ、患者に必要な治療が適切に届く仕組みを整備する」と述べ、再生医療等製品を含む新規治療の評価に取り組む姿勢を示した。
上野大臣は、今年1月の四病院団体協議会新年会員交流会でご挨拶されていた時にお見掛けした。昨年の福岡大臣の頃(プラス改定でも何でもなく、ただ病院経営が厳しいと言われ続けていた2025年の1月)より、かなり和やかなムードだったのが印象的だった。当然「本体プラス3.09%改定」が影響していたのだろう。
財務省関連のコメントだ。
〇財政審建議: 費用対効果評価制度等の一層の活用を含めた薬価制度上の最大限の対応が必要
2025年12月の財政審建議で、有効性評価が十分でない最先端医療等(再生医療等製品、がん遺伝子パネル検査等)など高額薬剤について、「費用対効果評価制度等の一層の活用を含めた薬価制度上の最大限の対応が必要。また、保険外併用療養費制度の柔軟な活用・拡大、民間保険の活用について検討を進めるべき」と記載された。
「費用対効果」という点において、大変残念ではあるが、冒頭「ハートシート」の保険取消は、限られた資源を有効に活用するという点においては必要だったのかもしれない。
続いて。
〇中医協委員
条件期限付き再生医療等製品2品目が通常承認を取得できず、薬価基準などから2024年度に削除されたことについて、昨年11月12日の中医協で、診療側の江澤和彦委員(日医常任理事)は、「製造販売会社は期限内については、当然患者さんが安心して治療を受けられるようにしていただくべきだ。できるだけ早期に有効性の検証が完了するよう、責任を持って相当の努力をしていただきたいと改めて要望する」と述べた。
診療側の森昌平委員(日本薬剤師会副会長)は、「再生医療等製品の特性について十分理解するが、患者のため、そして公的保険制度の中で、条件期限付き承認制度を運営していることから、本承認前の企業からの取り下げや、条件及び期限付承認の失効が発生しないよう、再生医療イノベーションフォーラムや日本バイオテク協議会の取り組みに期待する。それらに向けては、厚労省としても、しっかりと連携していくことをお願いしたい」と述べた。
松本真人委員(健康保険組合連合会理事)は、「今回の制度設計は、これから出てくる製品の有効性の確からしさが、過去に本承認に至らなかった2製品に比べて相当程度高いことを前提として了承するものだ。本承認に至らず、保険適用が削除するケースが続くようであれば、当然、より厳しい対応をとらざるを得ない」と牽制。「本承認に至らなかった場合に企業としてどのように対応するべきなのか、業界全体で真剣に検討いただきたい」と述べた。
松本委員のコメントは手厳しい。単なる「希望」とか「画期的」とか、そうあってほしいな、と思いたくなるような幻想を打ち砕くような、真冬の海の冷たさすら感じてしまう。
ただ、手厳しいが、命を支える医療が、高い技術力とエビデンス、信頼性によってはじめて成り立つことができているということを、あらためて感じさせるコメントだ。だからこそ、それだけの高いハードルを超えてきたという信頼性があるからこそ、患者(あるいは家族)は高額な治療費やその先にあるリスクがあったとしても、挑戦しようという気にもなろうというものだ。
創薬メーカーはどうか。
〇創薬メーカー
「承認取消しになった事例の検証により抽出された課題、その対応策などを踏まえながら、各企業においては今後の製品が本承認へ至るべく、その有効性、安全性の確立に向けて、真摯に対応していくものと確信している」(昨年11月12日の中医協で業界代表の越後園子専門委員(第一三共渉外部渉外部長))。
「再生医療を社会実装するには、研究開発だけでなく、製造・品質管理・流通まで含めた“産業としての仕組みづくり”が不可欠である。自動化や標準化が進むことで、より多くの患者さんに届けられるようになる。」
創薬という行為が、どれだけ厳しいことなのか、これまで何度か触れている。いわゆる「魔の川・死の谷・ダーウィンの海」だ。新商品・技術の社会実装でも同じことだが、こと医療技術に関しては、これまでのコメント群からも、さらにその孤高を感じてしまう。
続いて。
〇ハートシート関連
ハートシートは2018年にNature誌から「有効性のエビデンスが不十分」と批判された。これに対し、国内の再生医療研究者の間では、「外部対照の限界はあるが、臨床的意義はある」「重症心不全という対象疾患の特性上、ランダム化比較試験が難しい」「条件・期限付き承認制度の設計自体に課題がある」といった議論が行われている。
ハートシートについては、こんな議論もあるようだ。
再生医療についてのコメントだ。
〇再生医療について
「再生医療は、従来の治療では限界があった疾患に対して、新たな選択肢を提供しつつある。ただし、患者さんの期待が先行しやすいため、効果の幅やリスクについて丁寧な説明が欠かせない。」
「細胞治療は、投与して終わりではなく、長期的なフォローアップが重要。治療の価値は、短期的な改善だけでなく、生活の質の向上や進行抑制をどう評価するかにもかかっている。」
「日本の再生医療は、条件・期限付き承認制度など独自の枠組みで早期実用化を進めてきたが、エビデンス創出と安全性確保のバランスが問われている。制度の再設計が次のステージに向けた鍵になる。」
「安全で適切な治療を提供できるように規制を見直す必要。2025年8月に、東京都中央区のTHティーエスクリニック(現 東京サイエンスクリニック)にて自由診療として自家脂肪幹細胞投与を受けた患者さんが、投与後に亡くなるという大変痛ましい事故が起こった。ここ数年、再生医療の自由診療においては毎年のようにこういった事故が起こっている。日本再生医療学会でも、MSCの安全な静脈投与に関する論文を発表し、また有効性に関しても有効性が検証できる自由診療を検証型診療として推奨するなどの対応をとっているが、強制力はないため効果は限定的にならざるを得ない。医療機関はもちろんのこと、細胞加工施設や認定委員会を含め、安全で適切な治療を提供できるように規制を見直す必要性を感じる。」
高い技術とエビデンス、安全性の確保か。難しい…。
医業系コンサルタントからは再生医療の生業についてのコメントだ。
〇医業系コンサルタント
<再生医療クリニックの収益は?>
再生医療の治療単価は高い。関節治療で20〜80万円、美容領域で10〜40万円、幹細胞治療では100万円を超えるケースもある。しかし、症例数は一般の自由診療ほど多くないため、「継続治療を前提とした治療設計」が収益の安定性を左右する。再生医療に用いる細胞を“加工・培養・保管”するための専門施設CPC委託費・品質管理・行政対応・広告規制など、一般の自由診療とは異なるコスト構造が重くのしかかる。
高い技術とエビデンス、安全性の確保に高いコスト構造(そりゃそうなるわな)。
もっと難しい…。ダーウィンの海の、なんと深き事よ!!
最後にこんなコメントを。
〇患者(または家族)
「パーキンソン病は進行する病気で、日々の小さな変化に不安を感じることがある。それでも、住友ファーマが進めるiPS細胞を使った再生細胞医療の研究が前進していると知ると、未来に対する希望が生まれる。新しい治療には期待と不安の両方があるが、家族や医療者と相談しながら、自分にとって最善の選択をしていきたいと思っている。」
もう一度。
命を支える医療が、高い技術力とエビデンス、信頼性によってはじめて成り立つことができている再生医療。
それだけの高いハードルを超えてきたという信頼性があるからこそ、患者(あるいは家族)は、高額な治療費やその先にあるリスクがあったとしても、挑戦しようという気にもなろうというものだ。
応援はしているものの、研究者でもない、何のお役にも立てない、いわば外野(ヤジ馬)の筆者であるが、日本の再生医療が世界をリードしてくれることを願わずにいられない。
<ワタキューメディカルニュース事務局>